Aktualności
| tekst | tekst | tekst |
| tekst | tekst | tekst |
| tekst | tekst | tekst |
| tekst | tekst | tekst |
- organiczna z biochemią
30 września 2013
26 września 2013
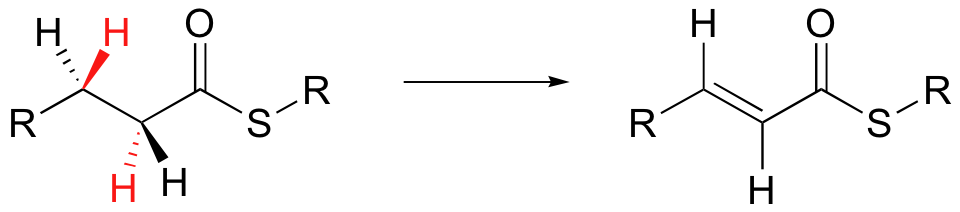
Wpływ skierowujący podstawników w związkach aromatycznych.
Oryginalny rozmiar strony 1
http://imageshack.us/a/img707/8633/lzuq.jpg Oryginalny rozmiar strony 2
http://imageshack.us/a/img818/5269/vcpj.jpg
Oryginalny rozmiar strony 3
http://img43.imageshack.us/img43/4411/fne6.jpg
{1} McMurry John, Chemia organiczna, T. 1, Wydawnictwo Naukowe PWN
Metody oceny wartości odżywczej białka
Metody oceny wartości odżywczej białka dzieli się na chemiczne i biologiczne.
Metody chemiczne polegają na oznaczeniu lub określeniu za pomocą tabel zawartości aminokwasów w produktach żywnościowych składu aminokwasowego danego białka, posiłku lub całodziennej diety.
Założeniem chemicznej metody oceny jakości białka jest porównanie składu aminokwasowego badanego białka ze składem białka wzorcowego, które teoretycznie powinno pokrywać zapotrzebowanie na aminokwasy u ludzi w różnym wieku, z wyjątkiem niemowląt.
Opierając się na tych przesłankach w 1965 roku - Komitet Ekspertów FAO/WHO jako wzorzec przyjmuje białko całego jaja kurzego, w 1973 roku - zmodyfikował jego skład ustalając tzw. prowizoryczne białko wzorcowe
Dla niemowląt najwłaściwszym białkiem wzorcowym jest białko mleka kobiecego, a dla zwierząt białko jaja lub mleka krowiego.
W 1991 roku - Komitet Ekspertów powtórnie zmodyfikował skład białka wzorcowego.
Skład ten uznawany jest obecnie za najodpowiedniejszy do oceny białka w żywieniu wszystkich grup ludności.
Przy określaniu jakości białka metodą chemiczną wykorzystuje się pojęcie tzw. aminokwasu egzogennego (takich, których organizm samodzielnie nie może syntetyzować, dlatego muszą być dostarczane z pożywieniem), który w danym białku lub posiłku występuje w najmniejszej ilości w porównaniu do wzorca.
Aminokwas ten ogranicza wykorzystanie innych aminokwasów z pożywienia do syntezy białka ustrojowego w takim stopniu, w jakim stanowi odsetek zawartości tego samego aminokwasu w białku wzorcowym.
Metody biologiczne stosowane w ocenie wartości odżywczej białka zakładają wykorzystanie do badań żywego ustroju. Do tego celu zwykle używa się zwierząt laboratoryjnych, najczęściej młodych, rosnących szczurów. Metody biologiczne polegają bądź na pomiarze przyrostu masy ciała młodych zwierząt karmionych testowanym białkiem, bądź na oznaczaniu ilości zatrzymanego azotu w ciele tych zwierząt.
Porównanie metod chemicznych z biologicznymi nie wykazuje pełnej zgodności. Jest to związane z nieuwzględnianiem strawności testowanych białek i dostępności z nich niektórych aminokwasów, np. lizyny. Największą zgodność między wskaźnikiem CS i NPU uzyskuje się dla produktów nieprzetwarzanych, zwłaszcza, gdy aminokwasem ograniczającym jest metionina lub walina. Na ogół wartości wskaźnika aminokwasu ograniczającego CS są dla danej mieszaniny białek niższe od oznaczonego współczynnika NPU.
Metody chemiczne polegają na oznaczeniu lub określeniu za pomocą tabel zawartości aminokwasów w produktach żywnościowych składu aminokwasowego danego białka, posiłku lub całodziennej diety.
Założeniem chemicznej metody oceny jakości białka jest porównanie składu aminokwasowego badanego białka ze składem białka wzorcowego, które teoretycznie powinno pokrywać zapotrzebowanie na aminokwasy u ludzi w różnym wieku, z wyjątkiem niemowląt.
Opierając się na tych przesłankach w 1965 roku - Komitet Ekspertów FAO/WHO jako wzorzec przyjmuje białko całego jaja kurzego, w 1973 roku - zmodyfikował jego skład ustalając tzw. prowizoryczne białko wzorcowe
Dla niemowląt najwłaściwszym białkiem wzorcowym jest białko mleka kobiecego, a dla zwierząt białko jaja lub mleka krowiego.
W 1991 roku - Komitet Ekspertów powtórnie zmodyfikował skład białka wzorcowego.
Skład ten uznawany jest obecnie za najodpowiedniejszy do oceny białka w żywieniu wszystkich grup ludności.
Przy określaniu jakości białka metodą chemiczną wykorzystuje się pojęcie tzw. aminokwasu egzogennego (takich, których organizm samodzielnie nie może syntetyzować, dlatego muszą być dostarczane z pożywieniem), który w danym białku lub posiłku występuje w najmniejszej ilości w porównaniu do wzorca.
Aminokwas ten ogranicza wykorzystanie innych aminokwasów z pożywienia do syntezy białka ustrojowego w takim stopniu, w jakim stanowi odsetek zawartości tego samego aminokwasu w białku wzorcowym.
Jeśli np. w danym posiłku znajduje się tylko 70% metioniny w przeliczeniu na 1 g azotu w porównaniu z białkiem wzorcowym, to tylko 70% aminokwasów będzie z niego zużytkowanych do syntezy własnego białka ustrojowego. Wartość odżywcza lub jakość białka w tym posiłku wyniesie więc 70% (jakość białka wzorcowego wynosi 100%).
Do najczęściej używanych metod chemicznej oceny wartości odżywczej białek należą:
× Wskaźnik aminokwasu ograniczającego CS (Chemical Score), inaczej wskaźnik aminokwasu ograniczającego (WAO) - zawartość poszczególnych aminokwasów w stosunku do zawartości w białku jaja kurzego
× Zintegrowany wskaźnik aminokwasów egzogennych - EAA (Essential Amino Acids Index). Jest to średnia geometryczna stosunku zawartości wszystkich aminokwasów egzogennych oraz histydyny i argininy w białku badanym do zawartości tych aminokwasów w białku wzorcowym
Metody biologiczne stosowane w ocenie wartości odżywczej białka zakładają wykorzystanie do badań żywego ustroju. Do tego celu zwykle używa się zwierząt laboratoryjnych, najczęściej młodych, rosnących szczurów. Metody biologiczne polegają bądź na pomiarze przyrostu masy ciała młodych zwierząt karmionych testowanym białkiem, bądź na oznaczaniu ilości zatrzymanego azotu w ciele tych zwierząt.
Do najbardziej rozpowszechnionych wskaźników wyznaczanych w ten sposób należą:

× NPU (Net Protein Utilisation) współczynnik wykorzystania białka netto (WBN)
× Współczynnik wydajności wzrostowej PER (Protein Efficiency Ratio)

×× Retencja białka netto NPR (Net Protein Retention) jest to modyfikacja PER, uwzględniająca potrzeby białkowe ustroju konieczne do utrzymania równowagi azotowej, ocenianej różnicą między przyrostem masy ciała zwierząt żywionych dietą białkową a ubytkiem masy ciała zwierząt karmionych dietą bezbiałkową.
×× Względna wartość białka RPV (Relative Protein Value). Współczynnik ten określa iloraz współczynnika regresji PER dla 3 różnych stężeń badanego białka w diecie, znacznie mniejszych od zapotrzebowania wzrostowego (2, 5 i 6%) i współczynnika regresji PER, oznaczonego w wyniku równolegle prowadzonego doświadczenia, w którym zwierzęta karmi się przez 2 tygodnie białkiem wzorcowym (laktoalbuminą lub kazeiną).
Wyraża się ją jako różnicę między ilością azotu oznaczoną w tuszkach zwierząt karmionych przez 10 dni dietą z badanym białkiem a ilością azotu w tuszkach szczurów otrzymujących przez ten sam czas dietę bezbiałkową, w odniesieniu do ilości azotu spożytego.
× Wartość biologiczna białka (WBB) - BV (Biological Yalue). Określa tę część wchłoniętego azotu (białka), która została zatrzymana w ustroju w celu pokrycia potrzeb endogennej przemiany azotu do utrzymania zrównoważonego bilansu azotowego lub pokrycia potrzeb syntezy białka w okresie wzrostu. Ocenia sieją na podstawie bilansu azotowego, przy uwzględnieniu poprawek na ilość azotu wydalonego z kałem i moczem w okresie karmienia dietą bezbiałkową.
× Wskaźnik bilansu azotowego K. Określa stosunek przyrostu bilansu azotowego do przyrostu azotu zawartego w dietach, które powodują nieznacznie ujemny, zerowy lub nieznacznie dodatni bilans azotowy. Wyniki oblicza się na podstawie pomiaru kąta nachylenia krzywej uzyskanej empirycznie lub obliczenia współczynnika regresji.
Do najczęściej używanych metod biologicznych oceny wartości odżywczej białka należy wskaźnik PER oraz współczynnik NPU.
Porównanie metod chemicznych z biologicznymi nie wykazuje pełnej zgodności. Jest to związane z nieuwzględnianiem strawności testowanych białek i dostępności z nich niektórych aminokwasów, np. lizyny. Największą zgodność między wskaźnikiem CS i NPU uzyskuje się dla produktów nieprzetwarzanych, zwłaszcza, gdy aminokwasem ograniczającym jest metionina lub walina. Na ogół wartości wskaźnika aminokwasu ograniczającego CS są dla danej mieszaniny białek niższe od oznaczonego współczynnika NPU.
Białko
|
NPU
|
CS
|
EAAJ
|
mleko
ser twardy
mąka pszenna
mięso wołowe
|
83%
78%
51%
82%
|
63 (Met)
80 (Met)
30 (Lys)
68 (Met)
|
87
49
70
78
|
24 września 2013
fizyka i astronomia | próbna matura ZamKoru 2011/2012
matematyka | próbna matura OPERON 2012
Próbny egzamin maturalny z matematyki
- (listopad 2012) Próbna Matura z OPERONEM i "Gazetą Wyborczą"
 arkusz poziom podstawowy
arkusz poziom podstawowy odpowiedzi do arkusza podstawowego
odpowiedzi do arkusza podstawowego
Literatura chemia
[1] Bezpłatna wersja A New System of Chemical Philosophy J. Dalton w języku angielskim - 'Google Książki'
|
[1] Kilka słów o autorze prof. dr. hab. Władysławie Gałasińskim w Medyku Bisłostockim, Miesięczniku Białostockiej Akademii Medycznej | nr1(48) | Białystok styczeń 2007.
22 września 2013
Charakterystyka wiązania atomowego.
W i ą z a n i a a t o m o w e (inaczej kowalencyjne) nie przewodzą prądu elektrycznego w stanie stopionym, ani w roztworach.
Całkowite przeniesienie elektronu z jednego atomu na drugi nie jest korzystne w przypadku atomów, które nie różniącej się znacznie elektroujemnością, jak również w przypadku pierwiastków ze środka układu okresowego. Dlatego więc atomy te inaczej dążą do uzupełnienia powłok walencyjnych. Dzieje się to na drodze uwspólnienia elektronów, czyli wspólnego zużytkowania przez dwa atomy jednej lub kilku utworzonych par elektronowych. Wspólna para elektronów tworzy jedno wiązanie, oznaczone we wzorach strukturalnych jedną kreską. Można przyjąć, że atom aby uzyskać konfigurację gazu szlachetnego "dysponuje" wszystkimi elektronami znajdującymi się na powłoce zewnętrznej (elektronami walencyjnymi), którymi dzieli się w wiązaniach kowalencyjnych wzajemnie z innymi atomami. Liczba wiązań kowalencyjnych, które tworzy atom równa się zwykle liczbie dodatkowych elektronów potrzebnych do osiągnięcia konfiguracji gazu szlachetnego. A zatem węgiel tworzy normalnie cztery, azot - trzy, a tlen - dwa wiązania kowalencyjne.
Wiązania atomowe powstają między atomami pierwiastków o jednakowych elektroujemnościach, a zatem najczęściej między atomami tego samego pierwiastka.
P r z y k ł a d y
[1] Władysław Gałasiński, Elementy chemii ogólnej, część I wykłady, Białystok 1989, s. 113-114
(2) Rys. 1: stworzony w gimp na podstawie rysunku z książki [1]
21 września 2013
Charakterystyka wiązania jonowego.
Dwa jony o przeciwnym znaku mogą tworzyć
cząsteczkę dzięki działaniu sił Coulomba.
Związki powstałe w ten sposób nazywamy jonowymi i
wiązania w nich występujące wiązaniami jonowymi (inaczej nazywane heteopolarnymi, różnobiegunowymi lub biegunowymi).
Wiązanie jonowe powstaje wskutek przekazania
elektronów pomiędzy atomami pierwiastków o dużych różnicach elektroujemności (wartości powinowactwa elektronowego).
Istotą powstawania wszystkich wiązań chemicznych
jest dążenie atomów do uzyskania trwałej konfiguracji elektronów walencyjnych
tzn. oktetu lub dubletu, charakterystyczne dla konfiguracji
gazów szlachetnych.
Atomy biorące udział w wiązaniu jonowym osiągają
zamkniętą powłokę elektronową najbliżej siebie położonego gazu szlachetnego.
P r z y k ł a d. Sód/Na posiada konfigurację elektronową 1s22s22p63s1. W wyniku jonizacji, elektron 3s1
zostaje usunięty, powstaje jon Na+ o konfiguracji
elektronowej: 1s22s22p2 odpowiadający
konfiguracji neonu. Chlor/Cl o konfiguracji 1s22s22p63s23p5,
w wyniku jonizacji, przyjmuje jeden elektron na orbital 3p i przechodzi w jon
Cl- o konfiguracji
elektronowej: 1s22s22o63s23p6
odpowiadającej konfiguracji argonu.
Im większa jest różnica
elektroujemności obu pierwiastków, tym mocniej jest zaznaczony charakter jonowy
wiązania. Elektroujemnością
pierwiastka nazywamy jego dążenie do przyłączenia elektronu. Wg skali elektroujemności Paulinga gazy
szlachetne mają wartość elektroujemności równą zeru, najwyższą ma fluor (4,0),
a najniższą poza gazami szlachetnymi mają cez (Cs=0,7) i frans (Fr=0,7).
Wielkość ładunku
elektrycznego nazywamy wartościowością jonową lub elektrowartościowością, która
jest równa liczbie elektronów, jaką atom stracił lub przyjął podczas reakcji
chemicznej, przechodząc w bardziej trwałą postać jonową. Może ona być dodatnia
lub ujemna.
szlachetnymi mają cez (Cs=0,7) i frans (Fr=0,7).
szlachetnymi mają cez (Cs=0,7) i frans (Fr=0,7).
O całkowitym przejściu elektronu z orbitalu jednego atomu na orbital drugiego atomu można mówić rozpatrując ten proces w roztworach (np.NaCl). W stanie krystalicznym elektron nie przechodzi całkowicie na orbital drugiego atomu, a pozostaje tylko w większym lub mniejszym stopniu w zasięgu oddziaływania drugiego atomu. Czyli w tym przypadku nie mamy do czynienia ze 100% czystym wiązaniem jonowym. Mniej lub bardziej jonowy charakter wiązania zależy od różnicy elektroujemności partnerów. Umownym przyjęto nazywać jonowym to wiązanie, w którym charakter jonowy sięga powyżej 50%.
W kryształach związków jonowych nie można wyróżnić izolowanych od siebie cząsteczek, gdyż wszystkie jony połączone są siłami o tym samym charakterze - siłami jonowymi. Istnieją tylko ugrupowania naładowanych cząsteczek, a mianowicie występują tylko jony dodatnie i ujemne, a cały kryształ można uważać za jedną ogromną cząsteczkę, w której ilość poszczególnych jonów odpowiada stechiometrycznie wzorowi cząsteczki. Każdy jon sodu w NaCl otoczony jest przez 6 atomów chloru, a każdy jon chloru otoczony jest przez 6 jonów sodu. Nie można więc odróżnić, który z jonów sodu należy do którego z jonów chloru i odwrotnie.
Związki jonowe charakteryzują się przewodnictwem prądu w stanie stopionym i w roztworach. W stanie stałym są złymi przewodnikami. Posiadają one wysokie temperatury wrzenia i topnienia.
[1] Władysław Gałasiński, Elementy chemii ogólnej, część I wykłady, Białystok 1989, s. 110-111
(2) Rys. 1: stworzony w gimp na podstawie rysunku z książki [1]
(3) Rys. 2: www.chemistry.wustl.edu
Jeżeli jesteś autorem tej grafiki i nie życzysz sobie aby była ona wyświetlana na tym blogu, skontaktuj się ze mną za pomocą formularza na dole strony, a niezwłocznie ją usunę.
If you are the author of this image and do not wish for it to appear on this blog, please contact me using the contact form at the bottom of the page, and I will remove it immediately.
Jeżeli jesteś autorem tej grafiki i nie życzysz sobie aby była ona wyświetlana na tym blogu, skontaktuj się ze mną za pomocą formularza na dole strony, a niezwłocznie ją usunę.
If you are the author of this image and do not wish for it to appear on this blog, please contact me using the contact form at the bottom of the page, and I will remove it immediately.
14 września 2013
Konfiguracje elektronowe pierwiastków, zakaz Pauliego, reguła Hunda.
Konfiguracja
elektronowa rozmieszczenie elektronów w powłokach i
podpowłokach
nlz
z - liczba elektronów
l - orbitalna
liczba atomowa
n - główna liczba kwantowa
Wyjątki przy zapisywaniu konfiguracji elektronowej to platyna, niob, ruten, technet, rod, molibden, pallad, srebro, złoto i miedź.
minimum
energetyczne elektrony zajmują w pierwszej
kolejności podpowłoki o mniejszej energii
Reguła (n + l)
Elektrony zajmują w pierwszej kolejności tę powłokę dla której suma (n + l) jest najmniejsza. Gdy dwie lub więcej podpowłok ma jednakową sumę (n + l) to o kolejności zapełniania decyduje mniejsza liczba n
n – główna liczba kwantowa
l – poboczna liczba kwantowa
Reguła
Hunda
- liczba niesparowanych elektronów w danej podpowłoce powinna być możliwie największa
- pary elektronów (↑↓) tworzą się dopiero po zapełnieniu wszystkich poziomów orbitalnych danej podpowłoki przez elektrony niesparowane
- elektrony niesparowane w poziomach orbitalnych danej podpowłoki mają jednakową orientację spinów
3p3 ↑ ↑ ↑
3p4 ↑↓ ↑ ↑
Zakaz
Pauliego
W atomie
nie mogą istnieć dwa elektrony, których stan kwantowy nie różniłby się
przynajmniej jedną liczbą kwantową
[1] Sawicka J., Janich-Kilian A., Cejner-Mania W., Urbańczyk G., Tablice chemiczne, Wyd. Podkowa, Gdańsk 2002
Orbital atomowy. (s i p)
orbital atomowy – najmniejszy obszar przestrzeni wokół jądrowej charakteryzujący się dużym prawdopodobieństwem znalezienia elektronu
powierzchnia graniczna orbitalu - powierzchnia ograniczająca obszar dużego prawdopodobieństwa znalezienia elektronu
Orbitale atomowe mają charakterystyczną energię i kształt. Różne kształty oznacza się różnymi literami.
orbital s - w całym obszarze elektron jest w
jednakowym stanie elektrycznym
orbital p - energia nie jest
jednakowa w każdym miejscu nie wszystkie kierunki są uprzywilejowane
stan podstawowy - stan o
najniższej wartości energii
stan wzbudzony - każdy
inny (warunek zajścia reakcji)
[1] Sawicka J., Janich-Kilian A., Cejner-Mania W., Urbańczyk G., Tablice chemiczne, Wyd. Podkowa, Gdańsk 2002
Author dlarsen |UC Davis ChemWiki by University of California, Davis is licensed under a Creative Commons Attribution-Noncommercial-Share Alike 3.0 United States License.
13 września 2013
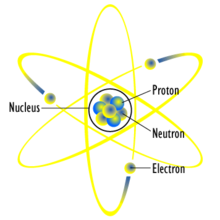
Teoria budowy atomu.
Atom jest najdrobniejszą część pierwiastka
zachowująca jego właściwości
Do odkrycia cząstek elementarnych przyczyniły się badania fizyczne. Wartość cząstki niosącą kwant ładunku ujemnego (1,6 ∙ 10-19 C) zwaną elektronem wykryto dzięki promieniowaniu katodowemu. Natomiast badania tzw. promieni kanalikowych doprowadziły do wykrycia i scharakteryzowania protonu.
Elementarne składniki atomu:
p - proton (ang.proton), ładunek dodatni
n - neutron (ang.
neutron),
e - elektron (ang.
electron), ładunek ujemny
Atom składa się z dodatnio naładowanego jądra, wokół którego krążą elektrony w postaci chmury elektronowej, czyli obszaru rozmytego ładunku elektrycznego. W skład jądra atomowego wchodzą protony i neutrony. Pojęcie chmura elektronowa zostało spopularyzowane przez noblistę Richarda Feynmana.
nuklid - zbiór atomów o tej samej wartości liczby atomowej i masowej,
nuklid - zbiór atomów o tej samej wartości liczby atomowej i masowej,
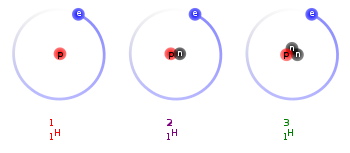
izotopy - różnią się liczbą n w jądrze, liczbą masową 
W 1931 roku Harold Clayton Ureya odkrył wodór ciężki - deuter, obecnie jest również znany trzeci izotop wodoru - tryt

W 1931 roku Harold Clayton Ureya odkrył wodór ciężki - deuter, obecnie jest również znany trzeci izotop wodoru - tryt
izobary - ta sama wartość liczby masowej, różna wartość liczby
atomowej
izotony - atomy o tej samej liczbie neutronów

izotony - atomy o tej samej liczbie neutronów
Model Josepha Johna Thomsona (1904)
Elektrony są rozmieszczone w kuli jak
"rodzynki w cieście"
Model planetarny Ernesta Rutherforda (1911)
W centralnej części atomu znajduje się
dodatnio naładowane jądro, w którym skoncentrowana jest prawie cała masa atomu.
Dookoła jądra po torach kołowych lub eliptycznych krążą elektrony. Rutherford
oszacował, że średnica atomu jest równa około 10-10 m, a
średnica jądra około 10-15 m,
Było to równie nieprawdopodobne jak odbicie się piętnastocentymetrowego pocisku od kawałka papierowej bibułki i jego powrót do lufy...
~Ernest Rutherford
o eksperymencie, w którym zauważył, że część dodatnio naładowanych cząstek odbija się od warstwy złota, po zbombardowaniu jej cząstkami α.
Postulaty Nielsa Bohra (1913)
W atomie wodoru elektron porusza się po jednej z możliwych orbit kołowych spełniających warunek:
mvr - orbitalny moment pędu
( m- masa, v - prędkość, r - promień orbity),
( m- masa, v - prędkość, r - promień orbity),
h-stała Plancka,
n - liczby naturalne 1, 2, 3, ... oznaczające numer kolejnych orbitali
Kwantowo-mechaniczny model atomu
Hipotez de Broglie (1924)
elektron jest jednocześnie cząstką
materii i falą o długości λ
równanie oznacza że każda cząstka o masie m poruszająca się z prędkością v może zachowywać się jak fala o długości λ
Dualizm korpuskularno-falowy elektronu po raz
pierwszy potwierdziło doświadczenie Davissona-Germera w 1927 roku
Zasada nieoznaczoności Heisenberga
Nie jest możliwe jednoczesne
określenie z dowolną dokładnością położenia i pędu cząstki elementarnej
∆x - błąd określenia położenia elektronu
∆px -błąd określenia
pędu cząstki x
h - stała Plancka
Równanie falowe Schrödingera
Hψ = Eψ
H -
operator Hamiltona,
ψ - amplituda prawdopodobieństwa
znalezienia elektronu w określonym miejscu o energii E (funkcja falowa)
E - energia
Rozwiązaniem równania Schrödingera jest funkcja falowa ψ, zwana orbitalem atomowym. Wartość |ψ|2 jest proporcjonalna do znalezienia elektronu na orbitalu
[1] Sawicka J.,
Janich-Kilian A., Cejner-Mania W., Urbańczyk G., Tablice chemiczne, Wyd. Podkowa, Gdańsk 2002
{6} http://pl.wikiquote.org/wiki/Ernest_Rutherford
{8} http://rutherford.pl/informacje/rozwoj-pogladow-na-temat-budowy-materii/
[2] Gałasiński W., Elementy chemii ogólnej, część I Wykłady, wydanie trzecie, Wyd. MCML, Białystok 1989, s 83-92
(4) Rys. 2: http://pl.wikipedia.org/wiki/Plik:Hydrogen_Deuterium_Tritium_Nuclei_Schematic.svg
derivative work: Uvainio (talk) Hydrogen_Deuterium_Tritium_Nuclei_Schmatic-ja.svg: Dirk Hünniger, translated by user:was a bee | CC by SA 3.0
(5) Rys. 3: http://pl.wikipedia.org/wiki/Plik:Model_atomu_Bohra.svg
PNG version based on English image: Kimbar | SVG version: Holek | Licencja GFDL | Ten plik udostępniony jest na licencji Creative Commons Uznanie autorstwa – Na tych samych warunkach 3.0 | GNU Licencji Wolnej Dokumentacji
derivative work: Uvainio (talk) Hydrogen_Deuterium_Tritium_Nuclei_Schmatic-ja.svg: Dirk Hünniger, translated by user:was a bee | CC by SA 3.0
(5) Rys. 3: http://pl.wikipedia.org/wiki/Plik:Model_atomu_Bohra.svg
PNG version based on English image: Kimbar | SVG version: Holek | Licencja GFDL | Ten plik udostępniony jest na licencji Creative Commons Uznanie autorstwa – Na tych samych warunkach 3.0 | GNU Licencji Wolnej Dokumentacji
{8} http://rutherford.pl/informacje/rozwoj-pogladow-na-temat-budowy-materii/
{9} http://www.hcc.mnscu.edu/chem/V.07/page_id_16085.html
{10} http://perunwit.w.interia.pl/xray.htm - promieniowanie katodowe
{11} http://open.agh.edu.pl/mod/resource/view.php?id=482 - odkrycie elektronu
{10} http://perunwit.w.interia.pl/xray.htm - promieniowanie katodowe
{11} http://open.agh.edu.pl/mod/resource/view.php?id=482 - odkrycie elektronu
Subskrybuj:
Posty (Atom)