Atom jest najdrobniejszą część pierwiastka
zachowująca jego właściwości
Do odkrycia cząstek elementarnych przyczyniły się badania fizyczne. Wartość cząstki niosącą kwant ładunku ujemnego (1,6 ∙ 10-19 C) zwaną elektronem wykryto dzięki promieniowaniu katodowemu. Natomiast badania tzw. promieni kanalikowych doprowadziły do wykrycia i scharakteryzowania protonu.
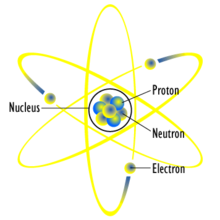
Elementarne składniki atomu:
p - proton (ang.proton), ładunek dodatni
n - neutron (ang.
neutron),
e - elektron (ang.
electron), ładunek ujemny
Atom składa się z dodatnio naładowanego jądra, wokół którego krążą elektrony w postaci chmury elektronowej, czyli obszaru rozmytego ładunku elektrycznego. W skład jądra atomowego wchodzą protony i neutrony. Pojęcie chmura elektronowa zostało spopularyzowane przez noblistę Richarda Feynmana.
nuklid - zbiór atomów o tej samej wartości liczby atomowej i masowej,
nuklid - zbiór atomów o tej samej wartości liczby atomowej i masowej,
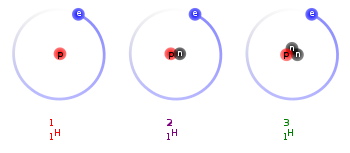
izotopy - różnią się liczbą n w jądrze, liczbą masową 
W 1931 roku Harold Clayton Ureya odkrył wodór ciężki - deuter, obecnie jest również znany trzeci izotop wodoru - tryt

W 1931 roku Harold Clayton Ureya odkrył wodór ciężki - deuter, obecnie jest również znany trzeci izotop wodoru - tryt
izobary - ta sama wartość liczby masowej, różna wartość liczby
atomowej
izotony - atomy o tej samej liczbie neutronów

izotony - atomy o tej samej liczbie neutronów
Model Josepha Johna Thomsona (1904)
Elektrony są rozmieszczone w kuli jak
"rodzynki w cieście"
Model planetarny Ernesta Rutherforda (1911)
W centralnej części atomu znajduje się
dodatnio naładowane jądro, w którym skoncentrowana jest prawie cała masa atomu.
Dookoła jądra po torach kołowych lub eliptycznych krążą elektrony. Rutherford
oszacował, że średnica atomu jest równa około 10-10 m, a
średnica jądra około 10-15 m,
Było to równie nieprawdopodobne jak odbicie się piętnastocentymetrowego pocisku od kawałka papierowej bibułki i jego powrót do lufy...
~Ernest Rutherford
o eksperymencie, w którym zauważył, że część dodatnio naładowanych cząstek odbija się od warstwy złota, po zbombardowaniu jej cząstkami α.
Postulaty Nielsa Bohra (1913)
W atomie wodoru elektron porusza się po jednej z możliwych orbit kołowych spełniających warunek:
mvr - orbitalny moment pędu
( m- masa, v - prędkość, r - promień orbity),
( m- masa, v - prędkość, r - promień orbity),
h-stała Plancka,
n - liczby naturalne 1, 2, 3, ... oznaczające numer kolejnych orbitali
Kwantowo-mechaniczny model atomu
Hipotez de Broglie (1924)
elektron jest jednocześnie cząstką
materii i falą o długości λ
równanie oznacza że każda cząstka o masie m poruszająca się z prędkością v może zachowywać się jak fala o długości λ
Dualizm korpuskularno-falowy elektronu po raz
pierwszy potwierdziło doświadczenie Davissona-Germera w 1927 roku
Zasada nieoznaczoności Heisenberga
Nie jest możliwe jednoczesne
określenie z dowolną dokładnością położenia i pędu cząstki elementarnej
∆x - błąd określenia położenia elektronu
∆px -błąd określenia
pędu cząstki x
h - stała Plancka
Równanie falowe Schrödingera
Hψ = Eψ
H -
operator Hamiltona,
ψ - amplituda prawdopodobieństwa
znalezienia elektronu w określonym miejscu o energii E (funkcja falowa)
E - energia
Rozwiązaniem równania Schrödingera jest funkcja falowa ψ, zwana orbitalem atomowym. Wartość |ψ|2 jest proporcjonalna do znalezienia elektronu na orbitalu
[1] Sawicka J.,
Janich-Kilian A., Cejner-Mania W., Urbańczyk G., Tablice chemiczne, Wyd. Podkowa, Gdańsk 2002
{6} http://pl.wikiquote.org/wiki/Ernest_Rutherford
{8} http://rutherford.pl/informacje/rozwoj-pogladow-na-temat-budowy-materii/
[2] Gałasiński W., Elementy chemii ogólnej, część I Wykłady, wydanie trzecie, Wyd. MCML, Białystok 1989, s 83-92
(4) Rys. 2: http://pl.wikipedia.org/wiki/Plik:Hydrogen_Deuterium_Tritium_Nuclei_Schematic.svg
derivative work: Uvainio (talk) Hydrogen_Deuterium_Tritium_Nuclei_Schmatic-ja.svg: Dirk Hünniger, translated by user:was a bee | CC by SA 3.0
(5) Rys. 3: http://pl.wikipedia.org/wiki/Plik:Model_atomu_Bohra.svg
PNG version based on English image: Kimbar | SVG version: Holek | Licencja GFDL | Ten plik udostępniony jest na licencji Creative Commons Uznanie autorstwa – Na tych samych warunkach 3.0 | GNU Licencji Wolnej Dokumentacji
derivative work: Uvainio (talk) Hydrogen_Deuterium_Tritium_Nuclei_Schmatic-ja.svg: Dirk Hünniger, translated by user:was a bee | CC by SA 3.0
(5) Rys. 3: http://pl.wikipedia.org/wiki/Plik:Model_atomu_Bohra.svg
PNG version based on English image: Kimbar | SVG version: Holek | Licencja GFDL | Ten plik udostępniony jest na licencji Creative Commons Uznanie autorstwa – Na tych samych warunkach 3.0 | GNU Licencji Wolnej Dokumentacji
{8} http://rutherford.pl/informacje/rozwoj-pogladow-na-temat-budowy-materii/
{9} http://www.hcc.mnscu.edu/chem/V.07/page_id_16085.html
{10} http://perunwit.w.interia.pl/xray.htm - promieniowanie katodowe
{11} http://open.agh.edu.pl/mod/resource/view.php?id=482 - odkrycie elektronu
{10} http://perunwit.w.interia.pl/xray.htm - promieniowanie katodowe
{11} http://open.agh.edu.pl/mod/resource/view.php?id=482 - odkrycie elektronu











Brak komentarzy:
Prześlij komentarz